系统能够高效编辑 DNA,它的出现已经彻底改变了基因组医学。然而,其对 DNA 的编辑是不可逆的,存在永久性脱靶风险,在一定程度上限制了其临床应用。
RNA作为遗传信息从 DNA 向蛋白质的传递过程中的桥梁,其源源不断地从 DNA 转录而来,因此,对 RNA 进行编辑具有瞬时性和可逆性,成为基因编辑疗法的一种更安全的替代方案。然而,当前主流的 RNA 编辑工具——CRISPR-Cas13,存在着一种重要缺陷——“旁系切割”:在识别目标 RNA 时也可能会无差别切割细胞内的其他RNA,可能引发严重的细胞毒性,这一问题长期阻碍了其临床应用。
该研究对 Cas9 的祖先IscB以及Cas9自身进行了工程化改造,删除了其 TID/PID 结构域,将它们从原本的 RNA 引导的 DNA 编辑器转换为RNA 引导的 RNA 编辑器,并展示其在可变剪切干扰、反式剪接及 RNA 碱基编辑中的应用潜力,其性能可媲美甚至超越了Cas13,且更具安全性,为 RNA 疗法、基因调控及基础研究提供了全新选择。

2021 年,张锋团队发现了Cas9 的祖先——IscB,这是一种来自 IS200/605 转座子家族的 RNA 引导的归巢核酸内切酶。IscB 蛋白的大小是典型的 Cas9 蛋白的三分之一到一半,缺少 Cas9 中的 REC 结构域,它采用了与 Cas9 类似的整体架构,通过相同的机制在 DNA 目标处进行搜索和切割。IscB 尺寸小且具有可调的 DNA 切割活性,这使其成为 CRISPR 2.0 型基因组编辑应用的理想平台,例如碱基编辑和先导编辑。虽然天然存在的 IscB 在人类细胞中的编辑效率较低,但已有多项研究表明,经过工程化改造的 IscB 能够实现更高的插入或删除以及碱基编辑效率。
实际上,作为 Cas9 的祖先,IscB 天然具备识别并结合单链DNA/RNA 的能力,但其在细胞内更倾向于识别和切割双链 DNA。在这项最新研究中,研究团队发现了关键奥秘——IscB 对 DNA 的识别依赖于TID 结构域(Target-Adjacent Motif Interaction Domain),使其在细胞内倾向于与双链 DNA 结合,忽略了 RNA。
基于这一发现,研究团队对 IscB 进行了工程化改造,开发出了删除 TID 结构域的 IscB——R-IscB(RNA-targeting IscB),其彻底失去了对双链 DNA 的结合和切割能力,而保留了识别单链 DNA/RNA 的能力,其对单链 RNA 具有极强的亲和力,远超 Cas13。
接下来,研究团队验证了 R-IscB 作为 RNA 引导的 RNA 编辑器的实际效果——
1、RNA 剪接调控,例如,靶向杜氏肌营养不良症(DMD)致病基因的异常剪接位点,成功实现了突变外显子跳跃,单次编辑使致病 mRNA 水平下降为之前的 1/8,效果媲美已上市的反义寡核苷酸(ASO)药物,且无高剂量脱靶风险。
2、反式剪接,R-IscB 还能够在细胞中实现有效的反式剪接,将正确的 mRNA 外显子片段引入突变 mRNA 的剪接位点,实现包括点突变、多点突变、外显子插入/缺失等多种错误的修复,有望用于简化囊性纤维化等复杂突变类型遗传病的治疗。
3、RNA 碱基编辑,将 R-IscB 与腺苷脱氨酶 ADAR2 融合, 实现了 A-to-I 的 RNA单碱基精确替换,可用于在 mRNA 水平修复致病点突变。
4、RNA 切割降解,通过对 R-IscB 的 HNH 核酸酶结构域进行工程化改造,进一步提高了其对单链 RNA 的切割活性,在细胞中显著降低目标 mRNA 的水平。
相比当前主流的 RNA 编辑工具——Cas13,R-IscB 具有多种颠覆性优势——
1、零毒性:细胞生长实验证实,R-IscB 处理组细胞无死亡或形态异常,而 Cas13 处理组细胞在 24 小时内大量凋亡;
3、小型化:R-IscB 的尺寸仅有 Cas13 的一半,更易装载于 AAV 病毒载体,适合进行体内递送,用于体内 RNA 编辑;
4、技术普适性:研究团队使用相同策略成功改造 4 种 Cas9 变体——NmeCas9、SaCas9、CjCas9、Cas9d,均使其获得了高效的 RNA 编辑能力。
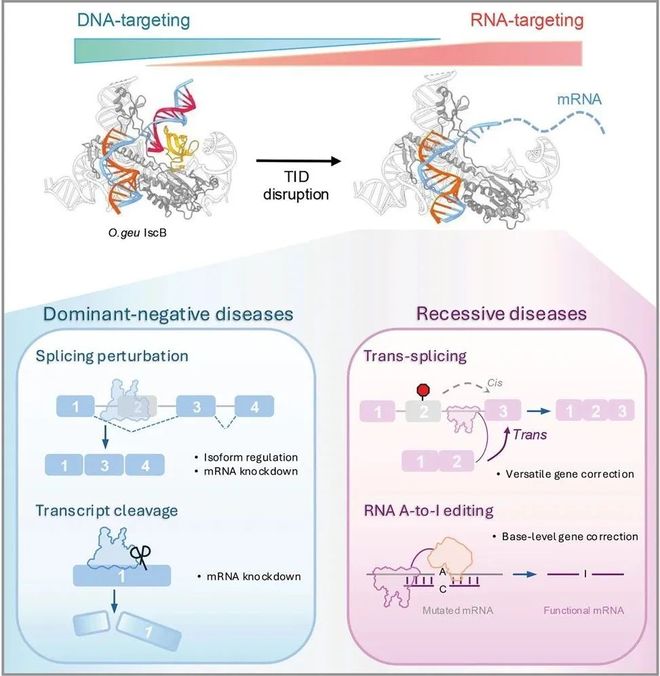
总的来说,该研究通过“做减法”,删除了 IscB 或 Cas9 中的 TID/PID 结构域,让它们从“基因剪刀”转变为“RNA手术刀”,这项研究突破了 RNA 编辑的技术瓶颈,带来了高效且更具安全性的 RNA 编辑新工具,为 RNA 疗法、基因调控及基础研究提供了全新选择。